定量聚合酶链反应(qPCR)分析具有高灵敏度,这是其成功并广泛应用于科学实验室的最重要原因之一。然而,包括移液技术在内的许多因素都会对qPCR分析的结果产生影响。在进行基于PCR原理的分析实验时,对于Master Mix的移液需重点关注良好的移液技术及耗材的正确选择,从而获得可重现且可靠的结果。
《如何移液PCR Master Mix以提高qPCR结果的准确性》应用说明中使用赛多利斯 Tacta® 手动移液器和Picus® 电动移液器进行了测试,证明使用低吸附移液器吸头搭配正向移液技术或使用标准移液器吸头搭配反向移液技术对Master Mix进行移液可获得良好的精准度和准确度,使用电动移液器确保了移液速度及结果的重现性。
引言
基于PCR原理的应用已成为生物制药工艺、临床诊断和学术研究的关键手段。然而,在执行定量聚合酶链反应(qPCR)时,分析结果的可变性可能是个问题。
在qPCR准备阶段,对Master Mix试剂进行移液具有挑战性。Master Mix通常由聚合酶、dNTP、MgCl2以及可能含有吐温和甘油成分的缓冲液组成。由于Master Mix必须在冰上存放,所以液体有点粘稠和冰冷,这些特性使得移取正确体积的Master Mix变得困难。
根据ISO-8655,应在移液前对移液器吸头进行预润洗,尤其是移取粘性液体时。对于粘性液体,预润洗的作用类似于反向移液技术中吸入的额外样品体积,并对因粘性液体在移液过程中粘附在标准塑料移液器吸头上而导致的样品损失进行补偿。目前,研究人员可以选择使用低吸附移液器吸头,当移取粘性液体时可大大减少滞留在移液器吸头上的残留样品量。
在本应用说明中,我们对Master Mix的移取进行了以下测试:
正向移液与反向移液
移液器吸头类型
预润洗
使用电动移液器的优势
方法
移液技术
移液器是一种精密仪器,它与吸头组合为一个系统来发挥作用。为避免因移液不当而导致数据变化,在整个实验过程中应坚持使用正确的移液技术,即在移液器上使用同厂家(赛多利斯)的吸头,以确保移液器和移液器吸头之间的恰当密封。在吸液过程中保持移液器垂直。吸液过程中,将吸头浸入Master Mix中的深度保持在2mm,以避免吸入体积过多,并避免过多的Master Mix粘附在移液器吸头外侧。在排液过程中,移液器呈45度角,移液器吸头接触PCR管的内侧。正向移液和反向移液技术如图1所示。
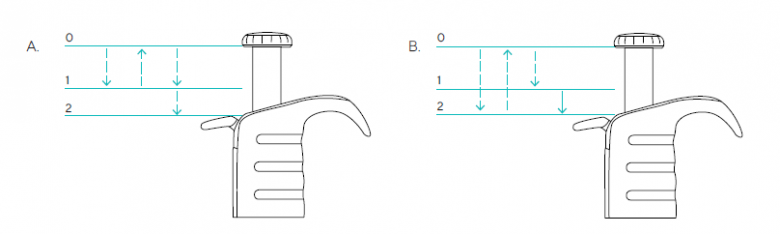
图1:(A)正向移液操作步骤和(B)反向移液操作步骤
qPCR准备
qPCR准备阶段使用赛多利斯移液器(Tacta® 手动移液器和Picus® Nxt 电动移液器)、赛多利斯SafetySpace滤芯吸头及低吸附滤芯吸头。使用Maxima SYBR Green qPCR Master Mix(不含ROX)、大肠杆菌uidA基因引物以及无核酸酶水来制备用于所有测试的PCR Master Mix储备液。用移液器重复将八个15μL的Master Mix移取至PCR板孔中,用于各种测试条件。
无模板对照(NTC)样品不含大肠杆菌基因组DNA,并加入了5μL无核酸酶水。用类似方法移取含有5μL大肠杆菌gDNA的系列稀释标准品(含有1×106,1×105,1×104,1×103 以及1×102个拷贝|反应)。在每个测试孔中加入5μL含有1×103个拷贝/反应的大肠杆菌gDNA。使用Picus® Nxt 电动移液器的多次分液功能配合低吸附滤芯吸头,以相同的方式将所有DNA样本添加到PCR管中。使用LightCycler® 480 qPCR仪进行qPCR分析。循环参数如下:在95℃下预培养10分钟,随后在95℃ 10秒、55℃ 10秒、75℃ 15秒,三步循环40次,最后在75℃下延伸10秒。对标准品、对照品和样品中的SYBR绿色荧光激发进行定量。使用LightCycler® 480软件确定定量循环定量循环(Cq)值和实际拷贝数,并使用MS Excel分析结果。
数据分析
移液过程中的系统误差是准确度的一种度量——它反映了所得结果与真实值的接近程度。Cq值的百分比系统误差(%S)反映了处理Master Mix的仪器系统(移液器和吸头系统)Cq值的误差。移液过程中的随机误差是结果精确度的一种度量,反映了实验中重复样品之间的差异。Cq值的百分比随机误差(%R)反映了结果的重现性,并且可能受到实验人员移液操作的影响。百分比不确定度的数值同时说明了结果的准确度(百分比系统误差)和精确度(百分比随机误差)。
结果
正向移液和反向移液
使用Tacta®手动移液器、标准SafetySpace滤芯吸头和低吸附滤芯吸头,对使用正向移液与反向移液移取Master Mix进行比较,并将正向移液预润洗与反向移液前的预润洗与否的结果进行比较。
如图2所示,使用低吸附滤芯吸头搭配正向移液技术获得了最佳的结果(Cq的百分比系统误差=0.02,Cq的百分比随机误差=0.46,Cq的百分比不确定度=0.9)。第二好的方法是使用标准滤芯吸头搭配反向移液技术(Cq的百分比系统误差=0.22,Cq的百分比随机误差=0.50,Cq的百分比不确定度=1.2)。
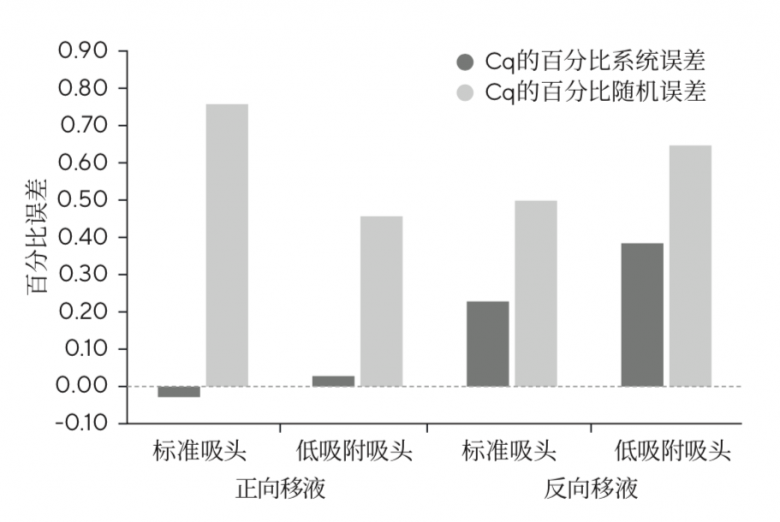
图2:Master Mix正向和反向移液的Cq(定量循环)百分比误差。显示了Cq(定量循环)的百分比系统误差和Cq的百分比随机误差。对于每个数据点,n=8。与反向移液相比,正向移液的系统误差较低(灰色条)。标准吸头为赛多利斯SafetySpace滤芯吸头,低吸附吸头为赛多利斯SafetySpace低吸附吸头。
因此,使用低吸附移液器吸头搭配正向移液技术或使用标准移液器吸头搭配反向移液技术是准确且精确地移取Master Mix的良好方法。这一结果还表明,低吸附移液器吸头的低吸附性能消除了反向移液技术或预润洗技术中由于液体的粘稠性而需要额外的样品去补偿粘附在标准移液器吸头上造成的损失。
移取Master Mix前对移液器吸头进行预润洗
预润洗能够调节空气置换式移液器的空气柱,并用额外的样品在移液器吸头的内侧形成液体膜,以提高结果的重现性(精确度,百分比随机误差)。使用Tacta® 手动移液器和标准SafetySpace滤芯吸头,在移取Master Mix之前对移液器吸头预润洗5次。如图3所示,与ISO-8655一致,对于使用标准滤芯吸头吸取Master Mix,与正向移液前不进行预润洗(Cq的百分比随机误差=0.8)相比,正向移液前预润洗吸头略微改善了结果的重现性(Cq的百分比随机误差=0.7)。然而,与使用正向移液搭配预润洗技术(Cq的百分比随机误差=0.7)相比,使用标准滤芯吸头搭配反向移液技术具有更好的结果重现性(Cq的百分比随机误差=0.5)。与预期结果相同,与反向移液前不进行预润洗(Cq的百分比随机误差=0.5)相比,反向移液前预润洗对结果的重现性没有显著影响(Cq的百分比随机误差=0.5),因此反向移液前无需预润洗标准滤芯吸头。值得注意的是,与在正向移液前进行预润洗(Cq的百分比随机误差=0.7)相比,使用低吸附滤芯吸头搭配正向移液技术移取Master Mix具有更好的重现性(Cq的百分比随机误差=0.5)。
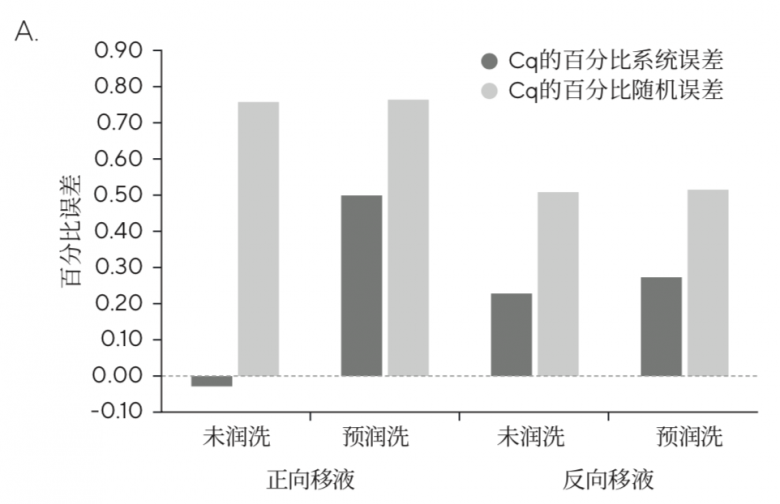
图3:(A)在移取Master Mix时,移液器吸头预润洗和不润洗的Cq(定量循环)百分比误差,显示了Cq(定量循环)的百分比系统误差和Cq的百分比随机误差。对于每个数据点,n=8。(B)量化的大肠杆菌uidA拷贝数。黄线表示实际目标数量。正向移液不润洗的系统误差比预润洗更低。标准吸头为赛多利斯SafetySpace滤芯吸头
低吸附移液器吸头及标准移液器吸头
使用赛多利斯低吸附滤芯吸头和SafetySpace滤芯吸头搭配Tacta® 手动精密移液器对适用于移取Master Mix的移液器吸头类型进行了测试。如图4所示,使用正向移液技术时,与搭配标准滤芯吸头(Cq百分比随机误差=0.8,Cq百分比系统误差=-0.03,百分比不确定度=1.6)相比,搭配低吸附滤芯吸头的重现性更好,且Cq值的不确定度更低(Cq百分比随机误差=0.5,Cq百分比系统误差=0.02,百分比不确定度=0.9)。这一结果表明,低吸附吸头最适合用于处理PCR Master Mix。
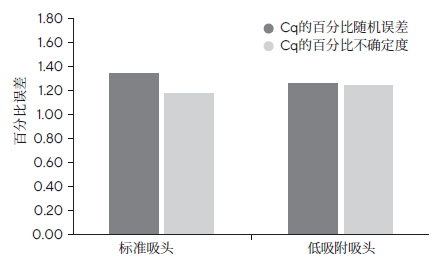
图4:使用标准吸头和低吸附吸头移取Master Mix的百分比误差。显示了Cq的百分比随机误差和Cq的百分比不确定度(百分比随机误差和百分比系统误差)。采用正向移液技术。对于每个数据点,n=8。与标准吸头相比,低吸附吸头的百分比不确定度较低。标准吸头为赛多利斯Safetyspace滤芯吸头,低吸附吸头为赛多利斯Safetyspace低吸附吸头。
电动移液器
使用赛多利斯Picus® Nxt电动移液器、赛多利斯Tacta®手动移液器搭配低吸附滤芯吸头,对移取Master Mix进行了对比测试。电动移液器使用了多次分液模式,手动移液器采用正向移液技术。如图5所示,当使用低吸附滤芯吸头移取Master Mix时,采用电动移液器的多次分液模式所得结果为:Cq=24.54±0.09,Cq的百分比系统误差=0.12,Cq的百分比随机误差=0.4,Cq的百分比不确定度=0.9;相比之下,采用手动移液器的正向移液所得结果为:Cq=24.52±0.11,Cq的百分比系统误差=0.02,Cq的百分比随机误差=0.5,Cq的百分比不确定度=0.9。使用电动移液器得到的结果具有良好的重现性(百分比随机误差),且其Cq值的总体百分比不确定度与手动移液器相当,都处于较低水平。电动移液器的多次分液模式可确保一次吸液,即可将Master Mix按顺序分配到所有八个重复孔中,显著提高了移液速度,并减少移液器吸头的使用数量,更环保的同时也减少了不同吸头之间的差异。
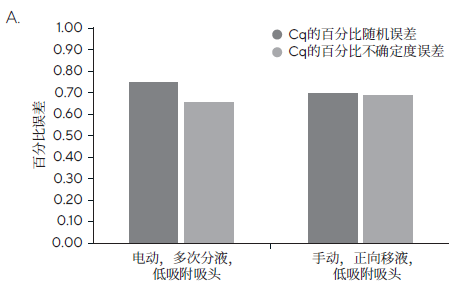
图5:(A)使用电动或手动移液器移取Master Mix时的误差百分比。显示了Cq的百分比随机误差和Cq的百分比不确定度(百分比随机误差和百分比系统误差)。手动移液器采用正向移液技术,电动移液器采用多次分液模式。(B)量化的大肠杆菌uidA拷贝数。黄线表示实际目标数量。对于每个数据点,n=8。低吸附吸头为赛多利斯SafetySpace低吸附吸头。
讨论
移液是PCR检测的基础。本研究证明了最佳技术搭配是使用正向移液技术搭配低吸附滤芯吸头,而标准移液器吸头移搭配反向移液技术可提供次佳的结果重现性(精密度)。还证明了电动移液器能够确保较高的准确度和精密度,并加快完成分析的速度,减少移液所需的时间,使操作更符合人体工程学。因此,它可以降低实验室工作人员患上重复性劳损(RSI)的可能性,并使实验更不容易出错;此外,它还能在相同的实验中使用更少的移液器吸头,因此也是更环保的选择。
Summary
我们从这项研究得出结论,PCR分析中移取Master Mix的最佳实践是使用最佳的移液器和移液器吸头组合(手动移液器或电动移液器,搭配低吸附移液器吸头)和正确的移液技术(使用低吸附吸头搭配正向移液技术,或使用标准移液器吸头搭配反向移液技术)。这些建议可确保准确、精确地移取Master Mix,从而将分析结果的可变性降至最低。
本研究结果特别适用于需要报告分析的CV%和Z因子,以便为最终用户提供最佳规格的分析开发、诊断和质量控制人员。这些指南对于执行定量分析的个人也很重要,例如确定肠道微生物群特征,其中细菌的定性和定量可通过qPCR分析进行,或在研发过程中测定细胞培养上清液和细胞培养基成分中的细菌污染,或用于合规性测试,例如根据EP/USP/JP 使用qPCR试剂盒进行测试,如赛多利斯Microsart® 研究细菌试剂盒。
了解更多信息,欢迎访问赛多利斯官网。
免责声明
本文仅代表作者观点,不代表本站立场,著作权归作者所有;作者投稿可能会经本站编辑修改或补充;本网站为服务于中国中小企业的公益性网站,部分文章来源于网络,百业信息网发布此文仅为传递信息,不代表百业信息网赞同其观点,不对内容真实性负责,仅供用户参考之用,不构成任何投资、使用建议。请读者自行核实真实性,以及可能存在的风险,任何后果均由读者自行承担。如广大用户朋友,发现稿件存在不实报道,欢迎读者反馈、纠正、举报问题;如有侵权,请反馈联系删除。(反馈入口)
本文链接:https://www.byxxw.com/zixun/30765.html- 上一篇: 港口物流沙盘模型,港口岸桥沙盘,港口轨道吊沙盘模型
- 下一篇: 女童手臂被夹门缝,民警消防合力救援